

成长的密码,什么在决定Biotech崛起的进程?
source link: https://www.36kr.com/p/2145768808941824
Go to the source link to view the article. You can view the picture content, updated content and better typesetting reading experience. If the link is broken, please click the button below to view the snapshot at that time.
几乎所有的中国biotech都是因为梦想而诞生。
在biopharma、bigpharma的感召下,国内创新药千帆竞发,一批批biotech也正努力爬上高处。这里面,未来也会诞生big pharma。
但不是所有的biotech都有机会,翻越研发、临床、生产、销售一座座大山,与big pharma顶峰相会,还有不少biotech很可能出师未捷身先死,被临床绊住跃迁的步伐。
Biotech的成长之路必然困难重重。如果看看美国过去几十年的历史,你会发现,biotech真的很难,能将企业一直经营下去的,实属意外。
这是一个勇敢者的游戏。尤其在当下市场环境,未完成商业化能力建设,收入不能支撑投入的biotech,还能否从市场获得持续的资本供给,是转型中的biotech需要直面的挑战。
如何在创新药世界找到自己的立足点,自己的优势及定位到底是什么,是所有biotech需要思考清楚的问题。
01 一款产品两种结果
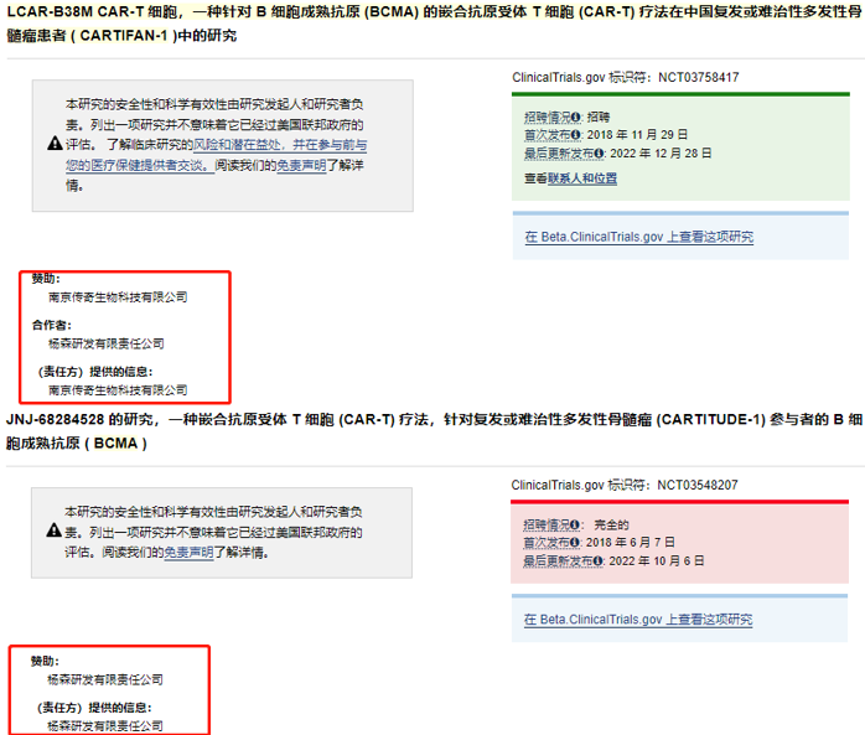
传奇生物,似乎就在临床研发阶段遇到了“阻力”。
作为传奇生物的拳头产品,BCMA CAR-T细胞疗法cilta-cel一直备受期待。不过,这款产品在中国和海外,却交上了两份不一样的答卷,无论是临床效果还是安全性,海外的数据均要强于国内。
具体来看,在美国和日本,强生/传奇生物开展了一项名为CARTITUDE-1的Ib/II期注册临床研究,用于评估cilta-cel治疗复发/难治性多发性骨髓瘤(RRMM)患者的安全性和有效性。
在这项临床试验中,中位随访12.4个月后,患者的客观缓解率高达97%,67%患者达到严格意义的完全缓解,18个月OS率分别为79%和81%。
数据一出,举座皆惊。要知道,百时美施贵宝同靶点产品Abecma的客观缓解率73%,严格完全缓解率仅33%。
当相同的临床试验在中国开展时,事情却发生了变化。国内临床试验结果没有海外结果一般炸裂。
在名为CARTIFAN-1的研究中,除了在中国进行临床实验未要求患者接受过抗CD38抗体治疗,其他患者基线特征与海外临床CARTIFUDE-1基本相当。
2022年10月,JCO杂志发表了该项研究的初步分析结果,中位随访18个月后,患者客观缓解率为89.6%,18个月PFS和OS率分别为66.8%和78.7%。虽然89.6%的客观缓解率仍然优秀,但和CARTITUDE-1相比,则仍有些差距。
更重要的是,在中国开展的这项临床试验中,患者的不良事件发生率和死亡率都更高。
在CARTIFAN-1试验中患者因为治疗相关原因死亡率达16.7%,而在美国临床试验中患者死亡率仅为6.2%;在中国试验中3/4级的细胞因子释放综合征为35%,美国试验仅为4%;中国试验感染发生率达到85%,在美国则为58%。
尽管这样的数据差异不会影响其申报上市,1月12日,传奇生物的西达基奥仑赛上市申请拟纳入优先审评。但一款产品两种结果,暴露出传奇生物作为biotech在临床端的短板。
02 能力不同带来的差异
一个不争的事实是,biotech和big pharma“能力悬殊”。简单来说,就是“我有xx方面的优势,你没有”。其中,比较核心的包括研发、销售、临床研发经验、人脉(如与监管、PI的关系、项目源)、资金等等。
传奇生物一款产品两种结果的原因,也在于此。
中国和海外进行的两项试验主导人并不相同,国内临床由传奇生物主导,海外临床则由其合作伙伴强生主导。不同的主导人有着不同的临床试验全流程管理能力,也造就了两个不同结果的临床试验。
这不难理解。对于CAR-T细胞疗法来说,治疗过程中的全流程管理至关重要。
一方面,CAR-T副作用较多。
百亿T细胞输入到人体内,为患者带来极佳效果的同时,也带来了免疫介导毒性,细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)等诸多副作用。这些副作用,一旦严重都可能危及患者生命。好在,只要临床发现及时、尽早干预,这些副作用都还是可逆的。
另一方面,CAR-T疗法对患者影响时间较久。
CAR-T细胞在体内的扩增与起效是长时间进行的,即便在CAR-T输注完成后的过程,患者身体状况仍持续处于相对脆弱的状态。
可以说,全流程管理是能够影响CAR-T治疗效果的。所以,在CAR-T临床试验中,对患者副反应全程监测、识别、早期用药干预调控及后续长期复查随访,至关重要。
而cilta-cel疗法在中外临床试验中表现出的安全性差异,也吸引了美国阿肯色大学医学博士Samer Al Hadid的注意。
他在《欧洲癌症杂志》上发表的一篇文章,对CARTIFAN-1临床试验中出现的患者死亡原因进行了分析。在Samer Al Hadid看来,CARTIFAN-1临床试验中患者的死亡一定程度上与全流程管理不到位有关。
具体而言,在中国进行的试验中,有2例与血小板减少症直接相关的死亡病例。按理来说,血小板减少是可以通过及时监测并输注血小板解决的;并且对于CAR-T治疗后的长期管理中,也包括必要时的输血治疗这一措施。
也就是说,患者可能需要输血的情况是一开始就需要考虑到的。
但这两名患者,都没能成功输注血小板,其中一名患者的死亡还是在输入cilta-cel后10天内发生的。根据临床协议,在cilta-cel输注后患者至少要住院两周。那么,为什么在住院期间还会出现患者无法输注血小板的情况?原因不得而知。
反观在美国进行的临床试验中,所有患者都有一套标准的不良反应预防、监测、以及管理方法执行。在海外临床试验患者中,并没有因血小板减少而出现死亡的情况。
当然,传奇生物的全流程管理能力也只是影响临床结果的因素之一,中国与海外医疗环境差异、可用的支持性治疗措施差异等因素,也都会影响到临床试验的结果。
但不可否认,在临床试验能力上,biotech和big pharma之间有不小的差距。没有强生的支持,或许传奇生物CAR-T的传奇也很难在海外上演。
就像如果没有财大气粗的辉瑞,BioNTech的新冠疫苗也不会率先上市,名声大噪。
除了钱,辉瑞解决了生产工艺上许多核心问题,把生产流程从最初的120天压缩到30天。并且,辉瑞在国际临床试验开展、上市报批和市场营销方面的经验,是biotech们难以望其项背的。
03 衡量biotech的另一个维度
对于biotech的考量,研发能力固然关键。是否拥有研发BIC,甚至FIC的能力,必然是值得考虑的一个因素。
但从创新药整体研发周期来说,研发只是环节之一,其后还涉及临床推进以及后续的商业化,甚至是国际化。任何一个环节拖沓,都足以改变一款药、甚至一家公司的预期。
具体到临床环节,不同的药企,临床推进能力会不尽相同。毕竟,临床推进的速度和效率,与临床团队人员构成、经验息息相关。
小到临床试验开展中的具体细节,比如如何筛选入组患者、如何对患者进行全流程管理等,大到整个临床试验方案的设计、推进,不同的临床团队,所具备的专业素养、管理能力和资源调动能力都不尽相同,反过来就会影响临床推进的速度和效率。这一点,在过去的国产PD-1研发竞赛上,已经体现的淋漓尽致。
Biotech在临床端的能力短板,也并未传奇生物一家的问题。
今年1月5日,康乃德公布IL-4Rα抗体CBP-201的II期临床详细数据:CBP-201各治疗组的各项有效性终点,都比不过赛诺菲的度普利尤单抗。CBP-201的预期,由me better变成了me worse。
康乃德给出的解释是,公司临床入组患者的特应性皮炎基线疾病严重程度,明显低于度普利尤单抗的SOLO1、SOLO2临床试验。这导致该IIb期试验在各个治疗组中观察到的EASI评分与基线的变化百分比,都较既往的IL-4Rα抗体3期特应性皮炎研究的结果更低。
简单来说,康乃德认为是临床设计而非抗体本身影响试验结果。
再比如,由于临床节奏拖沓,导致泽璟制药的核心产品多纳非尼还未上市,竞品索拉非尼仿制药已经登场,同类产品蓝海市场变红海,甚至最前线的PD-(L)1+抗血管疗法也已经获批,大有取代索拉非尼的势头。
如果涉及到出海,海外临床试验的风险把控和质量管理,对biotech的挑战更大。此前,FDA拒绝万春医药普纳布林上市,要求补充进行额外Ⅲ期临床证明获益;开拓药业新冠口服药III期临床试验中期数据不理想,向包括FDA在内的监管机构寻求同意以修改临床试验方案。
以上种种失利,都暴露出biotech在临床层面的不足。对于它们来说,提升临床能力是证明自己的重要一步,比如强化信息资源的获取和决策参考,再比如提高临床研究相关的人才和资源投入,并对可能出现的各种情况提前做好预案、管理。
03 没有偶然,更无侥幸
从强生和传奇生物二者对于临床试验的掌控力,以及其他biotech在临床端踩的坑,我们不难发现,biotech和bigpharma之间的能力差距。
这还只是临床,到了后期商业化层面,没有big pharma那样广泛的资源,biotech也难以放量。
管线做到上市,等同于有理想的销售额?答案,显然是否定的。医院资源、进院能力、销售人数和覆盖力度上,都是大药厂们常年累月积累的结果,这注定是biotech难以企及的。
当然,与bigpharma相比,biotech也有其独特优势。
简单来说,biotech小巧的体量决定了其在药物研发方面的灵活性。假如当前临床实验失败,可以马上舍弃这一款产品,开始新产品的研发,其试错的成本要比big pharma低太多。
同时由于视野的不同,biotech往往会避开热门靶点,发现一些并不为大药企所注意的小众区域,并获得一些令人惊艳的效果。因此新的药物和技术也更可能诞生于biotech。
尽管并不是所有biotech都需要与big pharma合作,很多biotech也未必入得了big pharma的法眼,但有数据表明,与big pharma有紧密关系的biotech,总成功率可以从18%提升至37%。并且,big pharma越早参与临床研发,产品的成功率越高。
参考美国,生物制药产业也早已形成了明确的分工合作,biotech主要负责研发,big pharma则依靠买买买,推进后端临床和商业化。
这种分工,就像单细胞向多细胞生物进化的过程。虽然大家都有相同的目标,那就是生存和繁荣,但各自只负责自己最在行的部分,进而提高整体运作效率,创造更多价值。
回到国内来看,biotech到底是靠自己,搏一个成为biopharma的机会,还是选择抱大腿,在大药企庇佑下安心做研发呢?
传奇生物的选择显然是后者。不过,过去更多的biotech选择前者。
因为在信达生物、百济神州bioPharma进阶的故事激励下,大多数国内biotech的梦想都是成为biopharma,最终跃迁为bigpharma。
但不要忘了,信达、百济们的成功,是在政策支持、资本追捧,以及赶上了百年难遇的靶点PD-1的背景之下。
如今,biotech想要在重复这一路径几乎再无可能。Biotech是时候回归现实,重新去思考自己的优势及定位,以及如何在竞争激烈的创新药研发竞赛中,找到立足之地。
关于这一点,没有偶然,更无侥幸。
本文来自微信公众号“氨基观察”(ID:anjiguancha),作者:方涛之,36氪经授权发布。
该文观点仅代表作者本人,36氪平台仅提供信息存储空间服务。
Recommend
About Joyk
Aggregate valuable and interesting links.
Joyk means Joy of geeK