

乔治·丘奇创造首个人类卵巢类器官,可支持卵子成熟,为治疗不孕症/卵巢癌等生殖系统疾...
source link: https://www.qianzhan.com/analyst/detail/329/230223-85c6dd24.html
Go to the source link to view the article. You can view the picture content, updated content and better typesetting reading experience. If the link is broken, please click the button below to view the snapshot at that time.
乔治·丘奇创造首个人类卵巢类器官,可支持卵子成熟,为治疗不孕症/卵巢癌等生殖系统疾病开辟新道路

作者|王聪 来源|生物世界(ID:ibioworld)
卵巢负责形成人类和其他哺乳动物生殖所需的卵子。在卵巢中发育成熟后,卵子就会被释放到输卵管中,在那里它可能会与精子相遇并完成受精作用。然而,目前科学家们对于卵子是如何在卵巢中形成的还知之甚少。这很大程度上是因为卵巢难以获取,因此很难在卵巢上进行相关实验。
卵巢的发育需要生殖细胞和几种类型的体细胞的结合。其中,颗粒细胞在卵泡形成和支持卵子发生中起着关键作用。尽管已有从人诱导多能干细胞(hiPSC)中诱导生成人原始生殖细胞样细胞(hPGCLC)的有效方案,但生颗粒细胞的方法一直难以捉摸。
卵子发生是女性生殖的核心过程,其基本功能单位是卵巢中的卵泡,因此,如果能从hiPSC中构建全人源卵泡体外模型,将极大地促进女性生殖、表观遗传学和人类发育研究。
2023年2月21日,哈佛大学乔治·丘奇(George Church)团队在 eLife 期刊发表了题为:Directed differentiation of human iPSCs to functional ovarian granulosa-like cells via transcription factor overexpression 的研究论文。
该研究将人类iPSC细胞定向分化为有功能的、全人源卵巢类器官,能够支持卵细胞成熟、发育卵泡并分泌性激素。这一卵巢类器官无需从患者体内获取卵巢组织的情况下用于研究人类卵巢生物学,以及开发治疗不孕症、卵巢癌等疾病的新疗法。
据悉,该技术已经授权给了一家名为 Gameto 的生物技术公司,该公司正在使用这一卵巢类器官技术开发治疗女性生殖系统疾病的新疗法。

之前的研究显示,激活iPSC中的特定转录因子可以使其再分化为颗粒细胞。在这项研究中,乔治·丘奇实验室根据之前的研究和遗传数据找到了35个可能与颗粒细胞形成有关的35个转录因子,然后对它们进行随机组合测试。
结果显示,同时过表达转录因子NR5A1和RUNX1,或同时过表达转录因子NR5A1和RUNX2,能够让iPSC再分化为颗粒样细胞。这些颗粒样细胞具有与人类胎儿卵巢细胞相似的转录组,并涵盖了关键的卵巢表型,包括卵泡形成和类固醇激素生成。

更高效的全人源卵巢类器官构建流程
更重要的是,将这些从人iPSC诱导而来的颗粒样细胞与同样从人iPSC诱导而来的人原始生殖细胞样细胞(hPGCLC)结合,能够形成卵巢类器官,帮助卵子发育。

人卵巢类器官中发育6天(左)和26天(右)的卵泡样结构
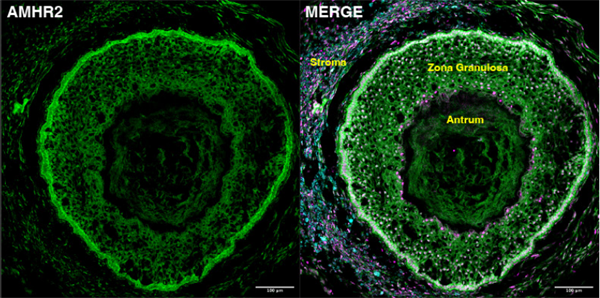
经过70天的发育,人卵巢类器官形成了卵泡结构,其特征是颗粒细胞环绕中央空腔排列
这些发现可以帮助研究人员建立稳定的系统来研究颗粒细胞在人类卵巢中的行为和功能,从而带来关于生殖健康的新见解。该卵巢类器官模型系统也将为研究人类卵巢生物学提供独特机会,有助于促进女性生殖健康疗法的发展。
论文共同第一作者 Merrick Pierson Smela 表示,该论文中的构建全人源卵巢类器官的方法,比以前构建的人/小鼠混合卵巢类器官(其中颗粒细胞来自小鼠)的方法要快上好几倍。而且这一全人源卵巢类器官能够复制卵巢的许多关键功能,这标志着在实验室研究女性生殖健康的能力向前迈进了一大步。在未来,这一技术还可能进一步发展,帮助那些卵子不发育或无法存活的女性培育卵子,从而治疗不孕症。
论文共同第一作者、Gameto公司副总裁 Christian Kramme 表示,从iPSC中诱导出颗粒细胞是一项重大成就,之前已有将人原始生殖细胞样细胞(hPGCLC)与小鼠颗粒细胞结合的研究,而这一次,我们有能力做出了全人源卵巢类器官模型,并用其研究卵子的发育和成熟。
目前,乔治·丘奇实验室正在继续开发人类卵巢类器官模型,并计划整合其他卵巢细胞类型,包括产生激素的膜细胞,以更全面地复制人类卵巢的复杂功能。他们还希望改进培养系统,让生殖细胞能够在其中完全发育成卵子,以及确定不同转录因子所需的最佳表达量。与此同时,Gameto公司也已经开始进行人类卵子成熟共培养系统的临床前研究。

Gameto 公司是一家位于纽约和波士顿的生物技术公司,致力于通过重编程卵巢细胞重新定义生殖寿命。Gameto 正在建立一个卵巢治疗平台,以逐步解决更年期问题、提高辅助生育能力以及女性不孕症问题。该公司于2020年和2022年分别完成了300万美元的种子轮融资和2000万美元的A轮融资。

Gameto 公司联合创始人兼CEO Dina Radenkovic
卵巢的衰老速度比身体其他器官快5倍,这增加了女性不孕、更年期提前和健康状况不佳的时间。卵巢快速衰老的特征,使其成为研究人类衰老的极佳模型。在人体其他器官还未衰老时,卵巢已经提前衰老,这在一定程度上导致了我们现在面临的社会和人口问题。鉴于人类整体健康寿命和寿命的显著增加,这种卵巢快速衰老的问题值得我们去解决。
Gameto 公司希望通过重编程技术减缓卵巢的衰老速度,将其与肝脏、大脑或皮肤等其他器官的衰老速度同步,从而改善辅助生殖结果、测试和开发治疗卵巢疾病的药物、降低更年期医疗负担。
参考资料:
https://www.gametogen.com/
https://elifesciences.org/articles/83291
编者按:本文转载自微信公众号:生物世界(ID:ibioworld),作者:王聪
Recommend
About Joyk
Aggregate valuable and interesting links.
Joyk means Joy of geeK