

葛均波院士/钱菊英教授团队结合仿生策略修饰外泌体,实现心脏修复的靶向治疗
source link: https://www.mittrchina.com/news/detail/10675
Go to the source link to view the article. You can view the picture content, updated content and better typesetting reading experience. If the link is broken, please click the button below to view the snapshot at that time.
麻省理工科技评论-葛均波院士/钱菊英教授团队结合仿生策略修饰外泌体,实现心脏修复的靶向治疗
目前,心血管疾病仍然是世界范围内发病率及致死率最高的病症之一。其中,急性心肌梗死是其最严重的表现形式。有研究证实,干细胞所分泌的外泌体能够部分模拟母细胞的功能,间充质干细胞(mesenchymal stem cells, MSCs)分泌的外泌体可减少心梗后心肌细胞凋亡,促进血管新生,调节免疫反应,从而减少心梗面积和改善心脏功能。
近年来,外泌体已成为一种新兴的无细胞治疗策略,能够治疗急性心肌梗死、高血压、心力衰竭和心肌病等疾病。同时,随着研究的不断深入,外泌体已开始进入临床实验阶段。当前,在心脑血管疾病的诊疗范围内,已注册有两项观察性临床实验和一项介入性临床实验。
然而,外泌体最终进入临床并造福患者,其实还有很长的一段路要走。其中,增加外泌体在靶器官、靶组织及靶细胞的分布是关键的一环。
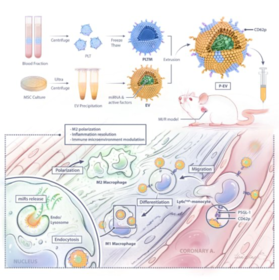
近期,复旦大学附属中山医院心内科葛均波/钱菊英团队将仿生的概念用于修饰外泌体,制备了可增加其靶向性的血小板膜融合细胞外囊泡(platelet membrane engineering extracellular vesicles,简称 P-EV),并较为详细系统的阐述了其靶向机制,可将 miRNA 递送至受体细胞胞浆内,实现了免疫细胞在体内的表型修饰,能够用于心脏修复的靶向治疗。
相关论文以《血小板膜工程细胞外囊泡通过连接外周单核细胞实现心脏修复的靶向免疫调节治疗》(Targeted immunomodulation therapy for cardiac repair by platelet membrane engineering extracellular vesicles via hitching peripheral monocytes)为题发表在 Biomaterials 上,复旦大学附属中山医院的心内科主治医师、复旦大学副研究员宋亚楠担任共同通讯作者。
审稿人认为,该工作非常有趣且实验设计十分合理,利用血小板膜修饰的细胞外囊泡去“劫持”体内单核细胞是一种比较高效的靶向递送策略。
宋亚楠介绍道,其实每个研究从立项到研究成功首先都离不开团队前期的工作,此次他们的研究也是基于其既往的研究基础。
据了解,该团队 1999 年开始就提出并开展了干细胞治疗心肌梗死及心脏修复相关的研究。他们发现,干细胞对心脏修复的疗效受到移植细胞归巢数量及其在心梗区存活状态的影响;而干细胞修复心脏的疗效,并非源自细胞分化,更多的是通过分泌多种活性物质实现的,其中就包括细胞外囊泡(extracellular vesicles, 简称 EV)。
EV 几乎可以由所有细胞类型分泌,主要包括外泌体、微泡及凋亡小体。公开资料显示,“外泌体是由细胞内的多泡体(multivesicular body,MVB)和细胞膜融合后释放到细胞外基质中的纳米级别的膜性囊泡,可运输丰富的蛋白质、脂质及 RNA 等物质,在连接细胞间的通讯中起到至关重要的作用。”
需要注意的是,外泌体要实现在心脏疾病治疗中的临床转化,还需克服产量等制约因素,并提高外泌体的靶向性才能完成高效的递送。
有研究表明,在移植物抗宿主疾病中,外泌体的有效剂量为 10^10 至 10^11 个/剂,且随着给药次数的增加,其剂量也往往需要增加。这就需要较长的细胞培养周期,不利于外泌体疗法的临床转化。
此外,外泌体输送至受体细胞需要经过血液运输,到达靶细胞并被摄取,同时释放 miRNAs 等活性货物至其作用靶点,这是改变细胞行为的重要一步。但外泌体在体内的半衰期通常较短,仅为 2~4 分钟,且主要分布在肝脾等单核吞噬细胞系统中。
而且,干细胞的外泌体虽有一定的靶向能力,其在心脏组织的分布仍然较少,目前研究使用的给药途径多为导管给药或心肌内局部注射,存在一定的创伤性,外泌体的脱靶效应也存在一定的副作用。
近年来,该团队与复旦大学药学院合作进行了大量有关仿生纳米材料靶向递送药物的研究。仿生纳米材料利用天然的细胞膜修饰纳米颗粒,采用“Top-down”的策略,完整地复制了细胞膜表面多样性抗原,利用细胞对特定疾病天然的归巢能力,极大的提高了纳米药物的靶向性。同时,基于细胞膜的仿生技术极大地简化了对纳米粒子多功能化的复杂修饰过程,具备优良的生物相容性、免疫相容性及延长的药物半衰期等优点。急性心梗后,血小板与单核细胞结合形成聚合物,并介导单核细胞向心梗区的趋化,是患者远期预后的独立预测因子。
基于这些研究成果,该团队设想:是否可使用天然的血小板膜修饰外泌体,从而提高外泌体对受体器官及细胞的靶向性,并进一步提高其疗效以促进临床转化?
研究中,该团队利用心梗后患者血液中血小板与单核细胞形成聚合体的病理生理学过程,提出使用血小板膜修饰外泌体,并尝试了多种血小板膜和细胞外囊泡融合的方法,最终成功利用仿生策略构建了血小板膜修饰的细胞外囊泡 P-EV。
相比于既以往的修饰方法,该团队采用的方法可使外泌体膜表面继承血小板完整的粘附分子系统,充分模拟血小板与单核细胞的结合能力,提高其靶向性。并且,P-EV 的制备过程不影响外泌体本身的活性物质,较好地保留了外泌体本身的功能。
值得一提的是,与传统的递送方式不同,P-EV 借助“搭便车”的方式到达了“目的地”。实验发现,由于 P-EV 表面富含血小板膜来源的粘附蛋白,经静脉注射后,P-EV 可以“劫持”外周血中活化的单核细胞。有趣的是,这些结合的囊泡并没有很快被单核细胞吞噬,而是随着单核细胞的趋化作用被募集到了受损心肌处,最终实现了心脏修复。
此外,该研究的靶向策略不依赖传统的 EPR(enhanced permeability and retention effect)效应,而是利用疾病本身的病理生理过程,主要依靠血小板及单核细胞在炎性状态下形成聚合体。
宋亚楠称,鉴于血小板-单核细胞聚合体在其他炎症性疾病中形成的普遍性及干细胞外泌体免疫调节的疗效,P-EV 不仅可以促进心脏在心梗后的修复,也可以用于治疗其他炎症性疾病,如动脉粥样硬化性疾病。同时,随着纳米科学的不断进步,通过将基因包载于 P-EV 的内部,P-EV 也可以作为一种靶向载体,用于基因的递送。
据了解,宋亚楠 2014 年毕业于复旦大学上海医学院临床医学八年制,获内科学博士学位,师从钱菊英教授。目前,她担任复旦大学附属中山医院的心内科主治医师以及复旦大学副研究员,长期从事于心血管内科临床工作。除常规开展冠脉介入手术外,宋亚楠还在围绕“纳米科学与心脏修复”开展一系列的纳米材料相关的转化应用基础研究。
她谈到,每个研究从立项到成功,过程其实都是无比艰苦和孤独的。在参与该研究的过程中,相比于实验的艰苦,她更难忘的是团队之间的合作、互助以及思想的碰撞。
此外,宋亚楠表示,他们在该研究中主要解决的问题是外泌体临床转化,但目前其研究还集中在概念验证上。未来,他们或将进行一些大动物如猪等的实验,为外泌体的临床转化提供更多的证据,并尝试将 P-EV 作为基因的载体,进行一些基因方面的治疗。
-End-
参考:
1.Qiyu Li. et al. Targeted immunomodulation therapy for cardiac repair by platelet membrane engineering extracellular vesicles via hitching peripheral monocytes. Biomaterials. (2022)https://doi.org/10.1016/j.biomaterials.2022.121529
Recommend
About Joyk
Aggregate valuable and interesting links.
Joyk means Joy of geeK