

与时间赛跑:mRNA疫苗的技术竞赛
source link: https://www.36kr.com/p/1719228193518856
Go to the source link to view the article. You can view the picture content, updated content and better typesetting reading experience. If the link is broken, please click the button below to view the snapshot at that time.

奥密克戎在上海的迅速蔓延一个多月,新冠病毒变异后传播力猛增的局面,使得全国医疗资源最丰富的地方也显得捉襟见肘。隐匿又迅猛的传播一方面让抗疫一线的压力猛增,另一方面也凸显了提升疫苗接种率的紧迫性。
同一时期的上海,120多家生物医药企业在以不到半数的人力资源超负荷运转,既有生产“达菲”的上海罗氏,也有加紧研发小分子新冠口服药的君实生物,还有恒瑞这样的市场巨无霸。
在不那么广为人知的上海医药产业版图里,还有一家以研发mRNA疫苗见长的biotech公司“斯微生物”。它的特殊性在于既非国企,也不是大型上市药企。而疫情期间,频繁出现在舆论潮头的疫苗研发,又给全国人民上了一堂生动的mRNA技术科普入门课。
马斯克一度将mRNA称为“医学的未来”——“mRNA就像一个电脑程序,你可以对其进行编程以执行所需的任何操作,你甚至都可以变成蝴蝶。医学的未来是mRNA,基本上你可以使用mRNA治愈一切[1]。”
对于斯微生物而言,近10年在mRNA疫苗上的高强度投入,不仅是商业层面的竞争,更是一次疫情期间与千万生命的赛跑。
01、中国需要自己的mRNA疫苗
2022年以来,新冠病毒奥密克戎变种的侵袭,也让mRNA疫苗这个话题再次成为了舆论的焦点。
最新的真实世界研究表明,在预防感染层面上,三针mRNA疫苗比三针灭活疫苗更有效。钟南山院士公布的一项巴西异源性疫苗接种结果也显示,接种两针科兴疫苗6个月后疫苗防感染的保护率降到了34.7%,防重症率72.5%。
而此时,如果加强一针mRNA疫苗,14到30天后疫苗抗感染的有效性激增到92.7%,防重症率达到97.3%[2]。
同一时期,伴随疫情的反复,舆论也在逐渐意识到这样一个事实:大量的轻症感染成为了疫情的关键;在防治重症的基础上,新冠疫苗的防感染效果越来越重要。而最新的真实数据表明,mRNA可以有效的答复降低轻症的感染,或许可能成为控制疫情的“杀手锏”。一时间,国产mRNA疫苗成了我国抗疫工具包内紧缺的“战略物资”。
4月上旬,国家药监局在24小时之内,一连批准了两款国产mRNA疫苗临床试验。而之前已进入临床阶段的艾博生物、斯微生物和艾美疫苗都在和时间赛跑。在不断反复的疫情面前,每一家药企都想成为率先交卷的尖子生。
正如斯微生物董事长李航文博士所说,做疫苗的人大都是有些情怀的。斯微生物从2016年开始研发mRNA疫苗相关技术,是国内最早布局这一领域的企业。新冠疫情爆发之后,斯微生物也迅速跟进,成为国内第二家进入临床阶段的mRNA疫苗企业。
对于mRNA这个大众层面鲜为人知的行业来说,新冠疫情是一台巨大的加速器。整个行业出现了跳跃式的发展,资本疯狂涌入这一赛道。但随之而来的,就是泡沫破裂的声音。
与Moderna、BioNTech并称mRNA三巨头的德国Curevac,2021年6月因为在研的新冠疫苗临床数据不佳,单日暴跌39%,如今市值只剩巅峰期的15%。
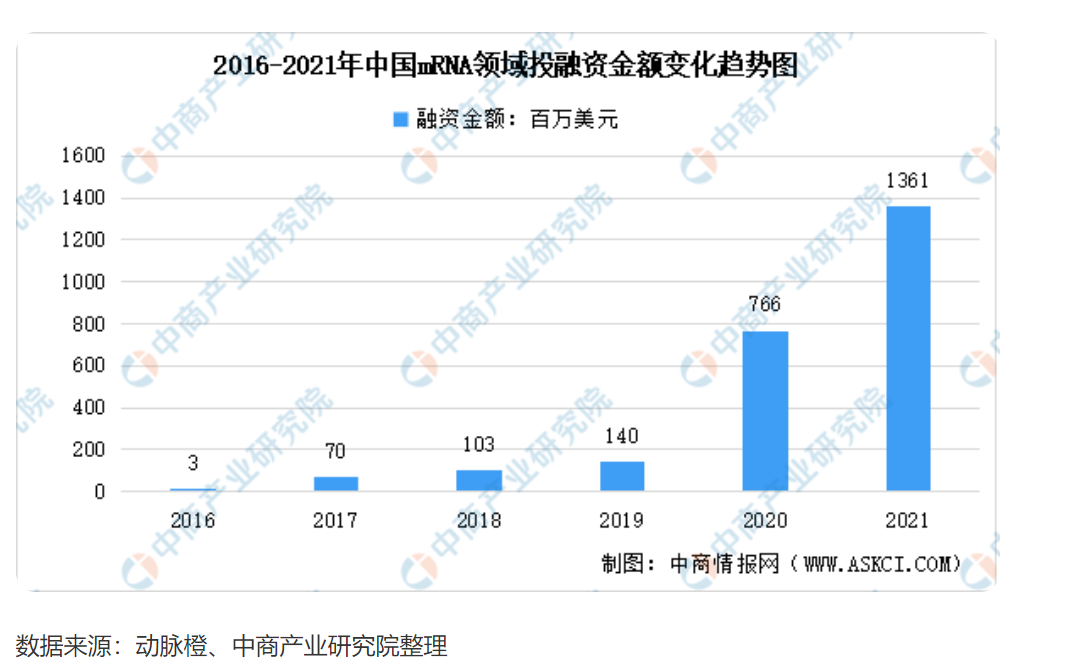
2019年以前,mRNA疫苗在国内属于无人问津的冷门赛道。而到了2022年4月,已有7家国内企业的mRNA疫苗进入临床阶段。这还不包括复星医药和BioNTech合作的“复必泰”(BNT162b2)。
看上去,距离国产mRNA疫苗的获批上市,已经只差一层窗户纸。横亘在国内企业面前的,是mRNA行业的三道必答难题:递送、给药、专利[3]。
02、三个难题与一个答案
对于这三个难题,斯微生物给出了同一个答案——LPP。
目前进入临床阶段的mRNA疫苗,大都使用了LNP递送技术,斯微生物则选择使用拥有自主知识产权的LPP递送技术。而递送系统,正是mRNA疫苗的know how。
mRNA疫苗虽然听起来尖端深奥,但其底层的基本原理非常简单,甚至没有超过高中生物学的大纲——mRNA也称为信使RNA,在遗传过程中充当DNA与蛋白质之间的桥梁。
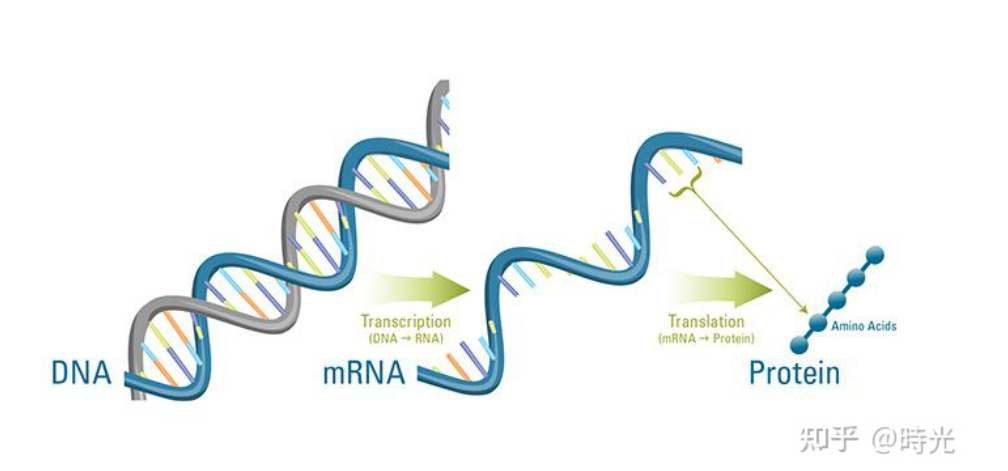
而mRNA新冠疫苗的设计思路,就是在病毒表面找一个mRNA,带着生产S蛋白的信息,指导细胞内的核糖体直接加工出S蛋白。而这些S蛋白就会成为抗原,引起人体的免疫反应。
不过就像原子弹的图纸大家都有,但没几个国家造得出来一样。一项技术从理论到产品,从产品到商业化,都是一座座难以跨越的大山,放在医药行业,还多了“临床”这一座大山。
放在mRNA疫苗上而言,mRNA是一个带负电荷的单链结构,极度脆弱。而细胞膜表面也是带负电的,mRNA根本不可能单刀直入,获得细胞的芳心。
因此,将mRNA送到细胞内的递送系统,就成为了mRNA疫苗的核心科技。
目前,mRNA的递送系统有LNP,LPP,LPX,LNC等等,但大多停留在“理论”的阶段。但目前进入临床阶段的,只有LNP和LPP两种。
LNP(Lipid Nanoparticle)递送技术,就是把mRNA包裹在由可电离的阳离子脂质、PEG化脂质、胆固醇和磷脂四种成分组成的纳米脂质体颗粒里面。目前所有采用LNP技术的mRNA疫苗,四种脂质的配比不能说毫无关系,只能说是一模一样。
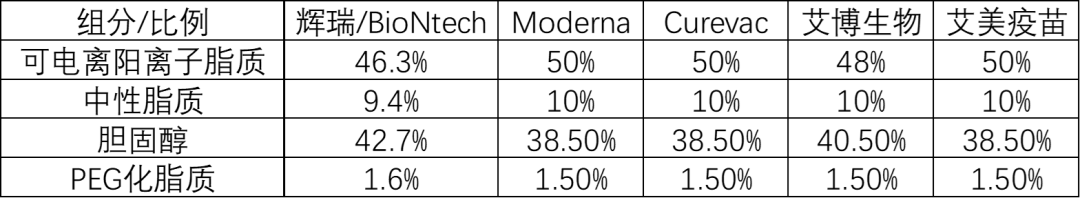
图片来源:海通国际
而LPP (lipopolyplex) 纳米递送平台则是一种以聚合物包载mRNA为内核、磷脂包裹为外壳的双层结构。LPP的双层纳米粒和传统的LNP相比具有更好的包载、保护mRNA的效果,并能够随聚合物的降解逐步释放mRNA分子。
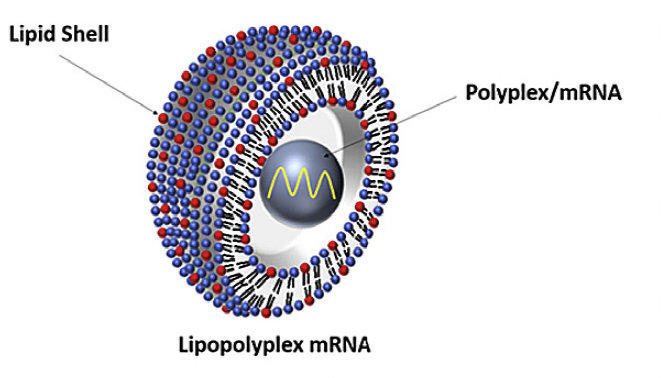
图片来源:斯微生物官网
打一个通俗的比方,LNP技术就是将四种组分按比例和mRNA片段混合在一起,用现在最先进的微流控技术混合(mix),然后做成mRNA疫苗,有点类似于蛋炒饭。饭要粒粒分开,还都要沾着蛋。通过PH值和有机溶剂的精准调节。绝大部分mRNA都和四种脂质体形成设计中的LNP-mRNA。这种结构有点类似于人体内外泌体(exosome),虽然也能被免疫细胞吞噬,但免疫细胞并不热衷于这种口味。
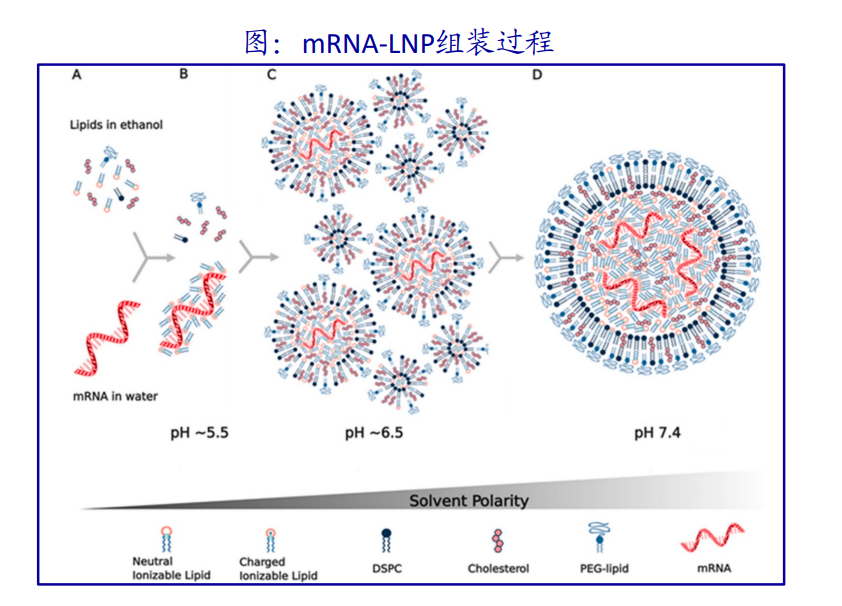
图片来源:海通国际
而LPP结构则是先将带正电的阳离子聚合物和带负电荷的mRNA混合成一个牢固的核,再将这个核和不同的脂质体混合成一个长得像病毒的核壳结构。mRNA受到双重保护,更不容易水解,有点类似于滚元宵,先做好馅儿,再裹上糯米粉。隔壁的小孩儿(树突状细胞和巨噬细胞)都馋疯了。同时,LPP-mRNA自带佐剂,使这些抗原递呈细胞保持活性状态。
在给药这一难题上,LPP独有的核壳结构也有很好的表现。目前已经上市的mRNA新冠疫苗都采取肌肉注射的方式给药,而未来的mRNA药物将应用在肿瘤治疗等更多的领域,需要更为精致的靶向制导。在这一点上,LPP的核壳结构可以通过调整不同的脂质体配比和电荷,将mRNA精确的递送到不同的人体器官。
除了在技术原理上的创新,LPP对于中国而言还有一个得天独厚的优势:避免很多专利上的潜在风险。
虽然LNP递送技术多为国内外巨头应用,但是LNP专利却来源于一家名不见经传的加拿大生物公司Arbutus。
Arbutus的前身Inex在20年前发现了LNP4种脂质体成分的黄金配比,并且申请了周密的专利保护。而目前各国药监部门批准的脂质体颗粒并不多,这也导致在LNP的框架内,很难绕开Arbutus的专利。作为mRNA领域市值最高的公司,Moderna就在LNP专利上吃了大亏。
2021年12月1日,Moderna与Arbutus的专利纠纷败诉,当日股价下跌11.87%,市值蒸发160亿美元。相当于40个Arbutus的体量。
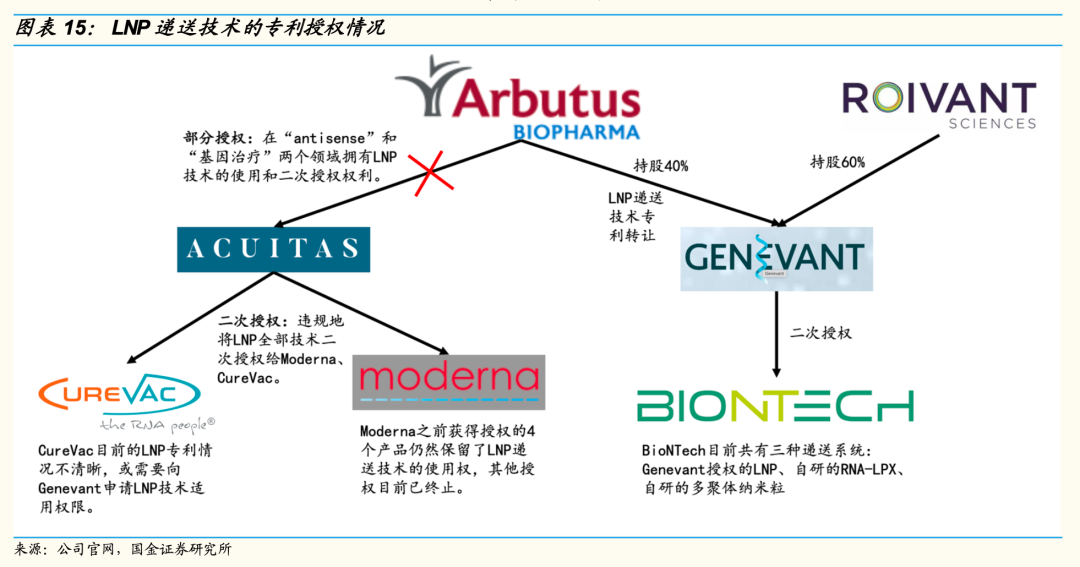
由于LNP的专利情况非常复杂,即使得到了专利授权,也并不能高枕无忧。2021年5月,在谈到mRNA疫苗时,钟南山院士曾经说过,“在突破科技创新方面的瓶颈,我从不指望国外,要靠自己[5]。”
对此,斯微生物的CTO,LPP技术的发明人沈海法教授有一个很有趣的比喻。LNP结构就好像燃油车。Arbutus研发出了福特的T型车,然后将所有四个轮子使用燃油发动机驱动的车型都申请了专利。
后来者很难在这个的框架内做出革命性的成果。而LPP则是完全不一样的结构,就像电动车一样,虽然目前渗透率还很低,但有着更多的可能性。更重要的是,它可以很容易避开专利上“卡脖子”的风险。
03、mRNA行业的未来
毫无疑问,生物医药的前沿阵地,已经从蛋白药物进入到核酸药物。而mRNA疫苗则是近年来核酸药物中异军突起的一匹黑马。它拥有5点核心优势。
(1)mRNA可以表达任意种类的蛋白,品种多;(2)mRNA可以同时表达多个蛋白,相比于传统蛋白药物成本更低;(3)mRNA疫苗生产周期极短,3个月内完成GMP生产及质量控制,可以应对大规模突发性疾病;(4)mRNA疫苗是一种平台型技术,复用性强;(5)同一生产线可用来生产不同疫苗产品,安全性高,质控有保证。
总结一下,就是一个品种多,研发快,效果好,成本省、复用性强的疫苗生产平台。但近年来大量的资本涌入,也会带来一个问题。mRNA行业的未来会和PD-1一样内卷吗?
对于这个问题,李航文博士认为,mRNA和PD-1有一点本质性的不同。
PD-1是一个产品,而mRNA则是一个完全模块化的平台型技术。虽然PD-1是一个百亿级别的市场,但和mRNA未来的无限可能相比,仍然相形见绌。
而在国内的mRNA疫苗企业当中,拥有完整平台型技术的企业并不多。如果这些领先企业的mRNA新冠疫苗能够获批上市,就能在短期内积累足够的技术和资金优势,和后续的竞争对手拉开身位。
正是基于这样的战略规划,斯微生物已经在上海建成了现代化生产工厂,可以实现4亿剂/年的生产规模。即使在上海疫情最严峻的时刻,在斯微的实验室和车间之中也依然是科研人员忙碌的身影。
他们所追逐的,并不是国外mRNA巨头的背影,而是中国mRNA产业的未来。
参考资料:
[1] 马斯克这个“疯子”,称mRNA是医学的未来,MedTrend医趋势
[2] 3针,死亡率降98.7%!,虎嗅
[3] mRNA疫苗的三道必答难题:递送、给药、专利,DeepTech深科技
[4] mRNA疫苗技术&难点全梳理&国内外代表企业,国金证券研究所
[5] 钟南山:突破技术瓶颈要靠自己,我从不指望国外,环球时报
[6] mRNA药物上游产业链 —扬帆起航,星辰大海 ,海通国际
该文观点仅代表作者本人,36氪平台仅提供信息存储空间服务。
Recommend
-
 17
17
赵伟:疫苗接种“竞赛”,一场与病毒的赛跑 开源证券赵伟 3小时前 作者:赵伟团队来源:赵伟宏观探索报告要点毫无疑问,疫苗接种状况是影响2021年宏观形势及市场走势的最核心变...
-
 8
8
开发 mRNA 疫苗的科学家 WinterIsComing (31822)发表于 2021年04月12日 19时59分...
-
 3
3
mRNA 疟疾疫苗对实验鼠提供全面的保护 WinterIsComing (31822)发表于 2021年06月1...
-
 11
11
打了mRNA疫苗,就能和新冠彻底拜拜了?出品丨虎嗅医疗组作者丨华北佛楼蜜题图丨Unsplash当我们在朋友圈里讨论着打疫苗的日子何时会结束,以及下一针究竟怎么打的时候,Nature的一则消息让我的精神近似穿越。Nature以同行...
-
 7
7
BioNTech计划开发针对疟疾的mRNA疫苗 来源:
-
 5
5
更新于 2021/07/30 | 创建于 2021/07/30 世界最强的mRNA疫苗保護力降到 39% 由于疫苗对Delta 变种病毒保护力下降,以色列总...
-
 8
8
首页 > 文章详情 mRNA疫苗三巨头背后的“贵人们” 18分钟前 1,493 本文来自格隆汇专栏: 医药魔方 ,作者:黎元 时代让mRNA...
-
 5
5
更新于 2021/12/2 | 创建于 2021/12/2 mRNA疫苗厂商对Omicron保护力意见不一 莫德纳(Moderna)高层预测,现行疫苗对Omicron变异株...
-
 5
5
Technology COVID-19 mRNA疫苗 最近,你可能听过很多关于COVID-19疫苗的信息,其中包括mRNA疫苗,常规疫苗。那么mRNA疫苗是怎么在人体免疫中发挥作...
-
 9
9
以色列研发出针对致命细菌的mRNA疫苗2023/03/21 18:47|By
About Joyk
Aggregate valuable and interesting links.
Joyk means Joy of geeK